MSC治疗肺纤维化的原理和临床应用
2023-04-20 09:12:51 来源:网络
特发性肺纤维化(idiopathic pulmonary fibrosis,IPF)是一种慢性、进行性、纤维化间质性肺炎,难以诊断,常常从症状发作到准确诊断之间具有时间差异,对IPF的治疗造成了难度。
患者刚刚病症发作时,组织学和胸部高分辨率CT检验结果和普通型间质性肺炎特征类似,往往被诊断为普通肺炎;但大多数患者病症的肺功能呈现缓慢、逐步、可预见地下降趋势,病人在活动时呼吸困难,并且逐渐加重,常伴有干咳。
特发性肺纤维化的发病原因尚不明确,患者的自然史差异很大,但肺功能快速下降会降低生活质量,如果不进行干预,最终导致死亡。
目前IPF诊断后平均生存期2.8年,5年生存期甚至低于部分肿瘤如肺癌和胰腺癌患者,仅有30%。所以特发性肺纤维化是一种类肿瘤疾病,被称为“不是癌症的癌症”。
IPF是一种破坏性的间质性肺病(ILD),其特征是肺间质瘢痕化,最终导致实质破坏和正常功能丧失。它主要影响的是60-75岁的男性,患病率为每10万人口13-20人。
呼吸困难是肺纤维化最常见的症状。当肺纤维化进展时,在静息时也会发生呼吸困难,严重的肺纤维化患者可出现进行性呼吸困难。其他症状有干咳,乏力,部分患者有杵状指和发绀。
肺组织纤维化的严重后果,导致正常肺组织结构改变,功能丧失。当大量没有气体交换功能的纤维化组织代替肺泡,则导致氧不能进入血液。因为不能进入血液,患者就会出现呼吸不畅,缺氧,酸中毒,丧失劳动力,严重者最后甚至死亡。
特发性肺纤维化目前的治疗方法主要有氧气疗法、肺部康复训练、肺移植、和药物治疗等。
其中相对有效的是肺移植和药物治疗,但肺移植受限于肺源和手术条件及治疗费用,而药物治疗疗效目前比较有限且存在较多的不良反应。
目前市场上针对性治疗特发性肺纤维化药物有两款,分别是吡非尼酮和尼达尼布。
这两种药物都得到了临床试验的批准,显示用力肺活量(FVC)下降率的改善。FVC在6个月内的下降是IPF疾病进展的最有力指标。但它们也存在较严重的不良反应,特别在胃肠道方面,有20%以上使用者因此而停药。
所以,特发性肺纤维化仍是一个巨大且急需被满足的临床需求。
间充质干细胞(Mesenchymal stem cell,MSC)是干细胞家族的重要成员,来源于早期的中胚层和外胚层,最初在骨髓中发现,具有多向分化潜能、造血支持和促进干细胞植入、免疫调控和自我复制等特点。主要治疗原理如下:
抗氧化机制:间充质干细胞具有一定的抗氧化和清除氧自由基的作用,有助于肺纤维化的减轻。
细胞融合、细胞间相互作用、分化、促进血管新生:这些机制或单独或相互作用,都将发挥抗纤维化作用。
抗炎和免疫调节机制:间充质干细胞通过分泌抗炎因子和抗菌多肽或者抑制促炎信号通路、上调炎症信号通路和细菌的吞噬作用等发挥抗炎的免疫调节作用,减轻肺纤维化。
旁分泌机制:间充质干细胞分泌诸多因子,包括肝细胞生长因子、血管生成素-1、血管内皮细胞生长因子、某些趋化因子、炎症因子和调节肽等,直接或间接减轻肺内炎症反应和肺纤维化。
2020年5月,意大利布雷西亚研究中心(CREM)的科研团队在《干细胞转化医学杂志》发布了一项研究。首次向人们展示了从人胎盘羊膜收集的间充质干细胞可以减缓肺纤维化的进展。这项研究有望为这种致命疾病带来新的治疗方法。

2019年,《干细胞转化医学杂志》杂志报道了人体内高剂量干细胞治疗特发性肺纤维化伴肺功能快速下降的临床研究结果。20名受试者被随机分为两组,分别为间充质干细胞治疗组和安慰剂组。肺功能指标的分析显示,间充质干细胞具有一定的治疗效果,遏制了肺纤维化的快速发展,安全性评估未发现治疗相关的显著不良反应事件,证明了干细胞治疗的有效性和安全性。
2018年,第三军医大学西南医院报道了利用间充质干细胞(UC-MSC)治疗放射性肺纤维化的观察结果。入组病人8例,通过支气管镜对肺纤维化病灶部位灌洗并单次注入间充质干细胞。
8位患者均能够耐受间充质干细胞治疗,随访观察无严重不良反应发生。6例患者自述气促、咳嗽等症状有所好转,CT肺密度下降,说明间充质干细胞治疗安全,耐受性好;能够减轻患者的临床症状,降低肺纤维化密度。
2017年,著名期刊《Chest》在线发表了一项关于同种异体人间充质干细胞治疗特发性肺纤维化I期安全性临床试验。9例轻度至中度特发性肺纤维化患者分成三组,静脉输注不同浓度的间充质干细胞。60周后的评估结果表明未发生严重不良事件,证明了间充质干细胞输注治疗轻、中度特发性肺纤维化的安全性。

患者刚刚病症发作时,组织学和胸部高分辨率CT检验结果和普通型间质性肺炎特征类似,往往被诊断为普通肺炎;但大多数患者病症的肺功能呈现缓慢、逐步、可预见地下降趋势,病人在活动时呼吸困难,并且逐渐加重,常伴有干咳。
特发性肺纤维化的发病原因尚不明确,患者的自然史差异很大,但肺功能快速下降会降低生活质量,如果不进行干预,最终导致死亡。
目前IPF诊断后平均生存期2.8年,5年生存期甚至低于部分肿瘤如肺癌和胰腺癌患者,仅有30%。所以特发性肺纤维化是一种类肿瘤疾病,被称为“不是癌症的癌症”。
IPF是一种破坏性的间质性肺病(ILD),其特征是肺间质瘢痕化,最终导致实质破坏和正常功能丧失。它主要影响的是60-75岁的男性,患病率为每10万人口13-20人。
呼吸困难是肺纤维化最常见的症状。当肺纤维化进展时,在静息时也会发生呼吸困难,严重的肺纤维化患者可出现进行性呼吸困难。其他症状有干咳,乏力,部分患者有杵状指和发绀。
肺组织纤维化的严重后果,导致正常肺组织结构改变,功能丧失。当大量没有气体交换功能的纤维化组织代替肺泡,则导致氧不能进入血液。因为不能进入血液,患者就会出现呼吸不畅,缺氧,酸中毒,丧失劳动力,严重者最后甚至死亡。
特发性肺纤维化的传统治疗方式
特发性肺纤维化目前的治疗方法主要有氧气疗法、肺部康复训练、肺移植、和药物治疗等。
其中相对有效的是肺移植和药物治疗,但肺移植受限于肺源和手术条件及治疗费用,而药物治疗疗效目前比较有限且存在较多的不良反应。
目前市场上针对性治疗特发性肺纤维化药物有两款,分别是吡非尼酮和尼达尼布。
这两种药物都得到了临床试验的批准,显示用力肺活量(FVC)下降率的改善。FVC在6个月内的下降是IPF疾病进展的最有力指标。但它们也存在较严重的不良反应,特别在胃肠道方面,有20%以上使用者因此而停药。
所以,特发性肺纤维化仍是一个巨大且急需被满足的临床需求。
MSC治疗特发性肺纤维化的原理
间充质干细胞(Mesenchymal stem cell,MSC)是干细胞家族的重要成员,来源于早期的中胚层和外胚层,最初在骨髓中发现,具有多向分化潜能、造血支持和促进干细胞植入、免疫调控和自我复制等特点。主要治疗原理如下:
抗氧化机制:间充质干细胞具有一定的抗氧化和清除氧自由基的作用,有助于肺纤维化的减轻。
细胞融合、细胞间相互作用、分化、促进血管新生:这些机制或单独或相互作用,都将发挥抗纤维化作用。
抗炎和免疫调节机制:间充质干细胞通过分泌抗炎因子和抗菌多肽或者抑制促炎信号通路、上调炎症信号通路和细菌的吞噬作用等发挥抗炎的免疫调节作用,减轻肺纤维化。
旁分泌机制:间充质干细胞分泌诸多因子,包括肝细胞生长因子、血管生成素-1、血管内皮细胞生长因子、某些趋化因子、炎症因子和调节肽等,直接或间接减轻肺内炎症反应和肺纤维化。
干细胞在肺纤维化中的临床应用
2020年5月,意大利布雷西亚研究中心(CREM)的科研团队在《干细胞转化医学杂志》发布了一项研究。首次向人们展示了从人胎盘羊膜收集的间充质干细胞可以减缓肺纤维化的进展。这项研究有望为这种致命疾病带来新的治疗方法。

2019年,《干细胞转化医学杂志》杂志报道了人体内高剂量干细胞治疗特发性肺纤维化伴肺功能快速下降的临床研究结果。20名受试者被随机分为两组,分别为间充质干细胞治疗组和安慰剂组。肺功能指标的分析显示,间充质干细胞具有一定的治疗效果,遏制了肺纤维化的快速发展,安全性评估未发现治疗相关的显著不良反应事件,证明了干细胞治疗的有效性和安全性。
2018年,第三军医大学西南医院报道了利用间充质干细胞(UC-MSC)治疗放射性肺纤维化的观察结果。入组病人8例,通过支气管镜对肺纤维化病灶部位灌洗并单次注入间充质干细胞。
8位患者均能够耐受间充质干细胞治疗,随访观察无严重不良反应发生。6例患者自述气促、咳嗽等症状有所好转,CT肺密度下降,说明间充质干细胞治疗安全,耐受性好;能够减轻患者的临床症状,降低肺纤维化密度。
2017年,著名期刊《Chest》在线发表了一项关于同种异体人间充质干细胞治疗特发性肺纤维化I期安全性临床试验。9例轻度至中度特发性肺纤维化患者分成三组,静脉输注不同浓度的间充质干细胞。60周后的评估结果表明未发生严重不良事件,证明了间充质干细胞输注治疗轻、中度特发性肺纤维化的安全性。
未来与展望
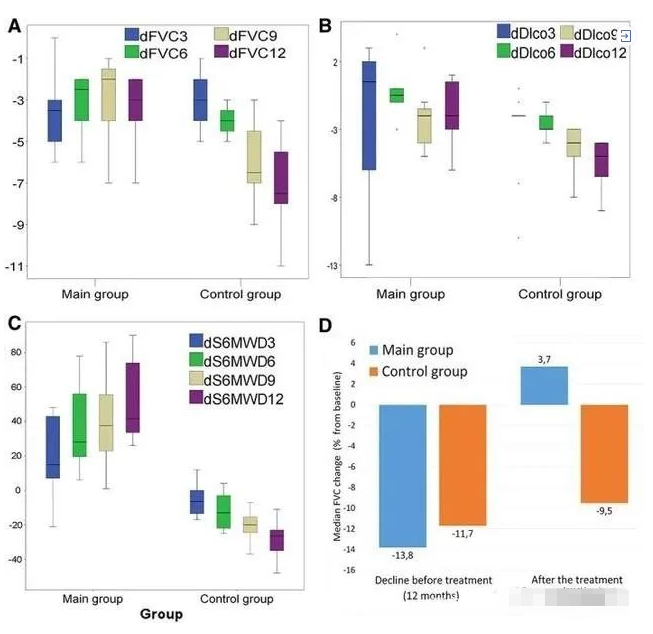
现有的临床试验结果展示了干细胞治疗肺纤维化的安全性和初步有效性,随着更多临床试验结果的输出,干细胞将对人类肺纤维化治疗与保护作出更大的贡献。
文章图片均来源于网络,侵删!
免责声明:本文仅作知识交流与分享及科普目的,不涉及商业宣传,不作为相关医疗指导或用药建议。
文章来源:本文转载自干细胞之父,文章仅用于信息交流,版权归属原作者所有。
快来分享:
